修回日期: 2018-02-27
接受日期: 2018-03-10
在线出版日期: 2018-03-28
探究腹腔感染患者腹腔引流液中病原菌分布及其耐药性情况.
选择2015-01/2017-11天津市宁河区医院就诊并行腹腔引流术的腹腔感染患者92例进行回顾性分析, 统计患者的腹腔引流液细菌培养和药敏结果, 分析不同菌群和耐药性的差异, 并应用Cox回归分析模型探究影响患者预后的独立危险因素.
共培养出菌株145例, 其中革兰氏阳性菌44株、革兰氏阴性菌97株和真菌4株; 大肠埃希菌(31.72%), 肺炎克雷伯杆菌(24.14%), 金黄色葡萄球菌(15.86%), 肠球菌属(11.72%), 铜绿假单胞菌(7.59%)的构成比较高. 金黄色葡萄球菌和肠球菌属的耐药率较高, 但均对万古霉素高度敏感; 其中, 肠球菌属对红霉素、氯霉素、左氧氟沙星的耐药率高于金黄色葡萄球菌, 金黄色葡萄球菌对氨苄青霉素的耐药性较高. G-菌属均存在较高的耐药率, 但均对β-内酰胺类/β-内酰胺酶(extended-spectrum β-lactamase, ESBLs)抑制剂、亚胺培南/西司他丁和阿米卡星具有较高的敏感性; 其中, 超广谱ESBLs+的菌属以及铜绿假单胞菌对头孢曲松、头孢他啶、头孢吡肟和左氧氟沙星的耐药率较高. 多因素Cox回归分析显示, 多重耐药菌(multi drug resistance bacteria, MDRO)、ESBLs+和发热至培养时间是腹腔感染患者死亡的独立危险因素.
腹腔感染患者腹腔引流液中病原菌分布以革兰氏阴性菌为主, 且病原菌对常用抗菌素具有较高的耐药性, MDRO、ESBLs+和发热至培养时间是腹腔感染患者死亡的独立危险因素.
核心提要: 本研究通过对本院行腹腔引流术的92例腹腔感染患者的病原菌分布和药敏情况进行回顾, 分析了不同菌属和菌种的分布情况, 以及不同菌种及其亚型对临床常用抗生素的敏感情况, 并探究了影响患者预后的相关危险因素.
引文著录: 魏寒松. 腹腔感染患者腹腔引流液中病原菌分布及其耐药性情况观察. 世界华人消化杂志 2018; 26(9): 550-556
Revised: February 27, 2018
Accepted: March 10, 2018
Published online: March 28, 2018
To identify the pathogenic bacteria in abdominal cavity drainage of patients with intraabdominal infection and to analyze their drug resistance.
From January 2015 to November 2017, 92 patients with intraperitoneal infection were treated by celiac drainage at our hospital. The bacterial culture and drug susceptibility results of peritoneal drainage fluid were statistically analyzed, and the differences in different bacterial populations and drug resistance were analyzed. Cox regression model was used to explore the independent risk factors affecting the prognosis of patients.
A total of 145 bacterial strains were cultured, including 46 Gram-positive and 97 Gram-negative strains. The top five pathogens were Escherichia coli (31.72%), Klebsiellosis pneumoniae (24.14%), Staphylococcus aureus (15.86%), Enterococcus (11.72%), and Pseudomonas aeruginosa (7.59%). Staphylococcus aureus and Enterococcus were two Gram-positive strains that had high resistance rates but were highly sensitive to vancomycin. Enterococci had high resistance rates to erythromycin, chloramphenicol, and levofloxacin than Staphylococcus aureus, which had a high resistance rate to ampicillin. Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, and other three kinds of G-bacteria had high resistance rates, but all of them had a high sensitivity to β-lactams/β-lactamase inhibitors, imipenem/Cistadine and amikacin; among them, extended spectrum beta lactamase (ESBL) producing strains and Pseudomonas aeruginosa had high resistance rates to ceftriaxone, ceftazidime, cefepime, and levofloxacin. Univariate Cox regression analysis showed that age, multidrug resistant organism (MDRO), nosocomial infection, ESBL positivity, and time from fever to culture were related to death in patients with intraabdominal infection. Multivariate Cox regression analysis showed that MDRO, ESBL positivity, and time from fever to culture were independent risk factors for death in patients with intraabdominal infection.
Main pathogens in peritoneal drainage fluid of patients with intraabdominal infection are Gram-negative bacteria, and the pathogens are highly resistant to commonly used antibiotics. MDRO, ESBL positivity, and time from fever to culture are independent risk factors for death from intraabdominal infection.
- Citation: Wei HS. Pathogenic bacteria in abdominal cavity drainage of patients with intraabdominal infection and their drug resistance. Shijie Huaren Xiaohua Zazhi 2018; 26(9): 550-556
- URL: https://www.wjgnet.com/1009-3079/full/v26/i9/550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i9.550
腹腔感染为病原体通过各种途径进入腹腔并造成腹腔内组织(如腹膜)和器官的严重感染性疾病, 通常继发于各种原因引起的开放性或闭合性损伤以及实质性器官或胃肠道感染性疾病[1]. 腹腔感染的病原菌通常较为复杂, 以肠杆菌科、金黄色葡萄球菌以及肠球菌属等细菌的混合感染为主[2], 且伴有较高的耐药性, 为临床治疗带来了较大的困难[3]. 为了解近3年来天津市宁河区医院腹腔感染患者的病原菌分布及其耐药性情况, 并探究影响患者预后的独立危险因素, 特进行了一项横截面调查, 报告如下.
对2015-01/2017-11于天津市宁河区医院就诊并行腹腔引流术的腹腔感染患者, 所有患者的诊断均符合世界急诊外科学会(World Society of Emergency Surgery, WSES)《腹腔内感染的管理(2017版)》[4]中的诊断要点. 共纳入患者92例, 男性51例, 女性44例, 年龄29-78岁, 平均年龄54.5岁±12.6岁, 其中, 腹部外伤31例, 胃肠穿孔12例, 感染性胆道疾病15例, 化脓性阑尾炎20例, 感染性胰腺炎10例, 其他7例. 所有患者均行开腹或腹腔镜下手术治疗, 并进行腹腔冲洗和引流术.
1.2.1 标本的留取: 在患者出现明显术前/应用抗生素前发热, 血象显著升高和其他严重感染征象时, 以及应用原有抗生素难以控制感染时, 对引流管路、引流口进行消毒, 在排除定植的前提下抽取引流液样本.
1.2.2 细菌培养: 使用Bact/Alert 3D 120全自动血培养仪(法国梅里埃公司)及其配套试剂, 在37℃下进行细菌培养.
1.2.3 分离鉴定与耐药性检测: 使用Vitek 2 Compact微生物鉴定与药敏分析系统(法国梅里埃公司)及其配套试剂对培养样本进行细菌分析、分离鉴定和耐药性分析, 分析过程遵循美国临床和实验室标准化研究所(Clinical and Laboratory Standards Institute, CLSI)的CLSI-m100s(第26版)中的相关要求、药敏方法和判定标准[4].
1.2.4 判定标准: 药敏判定标准采用敏感(sensitive, S)、中介(intermediary, I)和耐药(resistance, R)表示. 多重耐药菌(multi drug resistance bacteria, MDRO)指对通常敏感的常用的3类抗生素药物(如β-内酰胺类、大环内脂类、氨基糖苷类和/或磺胺异唑类或喹诺酮类等任意3类)均呈现耐药. 对于肠杆菌科菌株(包括大肠埃希菌和肺炎克雷伯菌等)使用双纸片法进行产超广谱β-内酰胺酶(extended-Spectrum β-lactamase, ESBLs)的检测[5].
统计学处理 数据处理采用软件SPSS23.0进行, 计数资料采用构成比的形式表示, χ2检验或Fisher确切检验比较组间差异; 计量资料以mean±SD的形式表示, 组间比较采用t检验. 应用Cox回归分析探究腹腔感染患者死亡的相关独立危险因素. P<0.05为差异具有统计学意义.
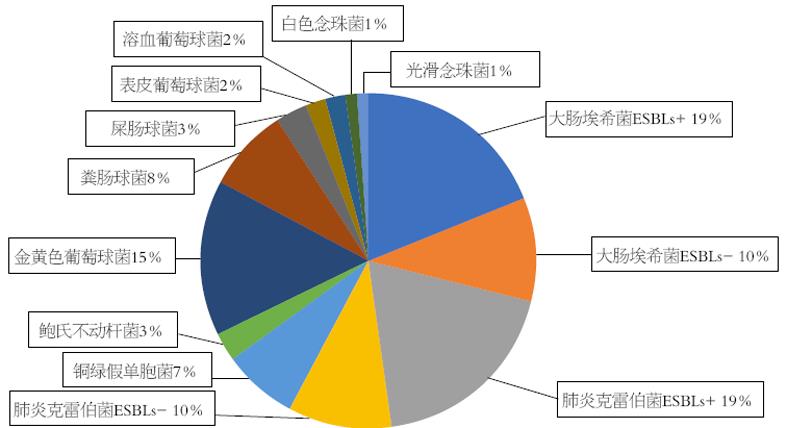
在纳入的92例患者中, 共培养出菌株145例, 革兰氏阳性菌和革兰氏阴性菌分别为44株和97株; 前5位的病原菌的构成比依次为, 大肠埃希菌(31.72%), 肺炎克雷伯杆菌(24.14%), 金黄色葡萄球菌(15.86%), 肠球菌属(11.72%), 铜绿假单胞菌(7.59%)(表1, 图1).
| 病原菌 | n | 构成比 |
| 革兰阴性菌 | 97 | 66.90 |
| 大肠埃希菌 | 46 | 31.72 |
| ESBLs+ | 30 | 20.69 |
| ESBLs- | 16 | 11.03 |
| 肺炎克雷伯菌 | 35 | 24.14 |
| ESBLs+ | 17 | 11.72 |
| ESBLs- | 18 | 12.41 |
| 铜绿假单胞菌 | 11 | 7.59 |
| 鲍氏不动杆菌 | 5 | 3.45 |
| 革兰阳性菌 | 44 | 30.34 |
| 金黄色葡萄球菌 | 23 | 15.86 |
| 粪肠球菌 | 12 | 8.28 |
| 屎肠球菌 | 5 | 3.45 |
| 表皮葡萄球菌 | 2 | 1.38 |
| 溶血葡萄球菌 | 2 | 1.38 |
| 真菌 | 4 | 2.76 |
| 白色念珠菌 | 2 | 1.38 |
| 光滑念珠菌 | 2 | 1.38 |
两种G+菌属均存在较高的耐药率, 其中, 肠球菌属对红霉素(70.59%)、氯霉素(70.59%)、左氧氟沙星(82.35%)的耐药率高于金黄色葡萄球菌(P<0.05), 金黄色葡萄球菌对氨苄青霉素的耐药性较高(73.91%), 两种菌属均对万古霉素高度敏感(100%)(表2).
| 抗生素 | 耐药性 | 金黄色葡萄球菌 | 肠球菌属 |
| 红霉素 | S | 43.48 | 29.41 |
| I | 21.74 | 0 | |
| R | 34.78 | 70.59 | |
| 氯霉素 | S | 52.17 | 29.41 |
| I | 26.09 | 0 | |
| R | 21.74 | 70.59 | |
| 氨苄青霉素 | S | 21.74 | 41.18 |
| I | 4.35 | 11.76 | |
| R | 73.91 | 47.06 | |
| 万古霉素 | S | 100 | 100 |
| I | 0 | 0 | |
| R | 0 | 0 | |
| 环丙沙星 | S | 34.78 | 17.65 |
| I | 13.04 | 0 | |
| R | 52.17 | 82.35 | |
| 左氧氟沙星 | S | 43.48 | 17.65 |
| I | 8.7 | 0 | |
| R | 47.83 | 82.35 | |
| 利福平 | S | 69.57 | 58.82 |
| I | 8.7 | 5.88 | |
| R | 21.74 | 35.29 | |
| 复方新诺明 | S | 78.26 | 82.35 |
| I | 4.35 | 0 | |
| R | 17.39 | 17.65 |
3种G-菌属均存在较高的耐药率, 其中, ESBLs+的菌属以及铜绿假单胞菌对三代曲松(80%、41.18%、36.36%)、头孢他啶(40%、36.36%、45.45%)和左氧氟沙星(63.33%、29.41%、63.64%)的耐药率较高; 3种菌属均对β-内酰胺类/ESBLs抑制剂(96.67%、76.47%、54.55%)、亚胺培南/西司他丁(96.67%、58.82%、63.64%)和阿米卡星(96.67%、76.47%、45.45%)具有较高的敏感性(表3).
| 抗生素 | 耐药性 | 大肠埃希菌 | 肺炎克雷伯菌 | 铜绿假单胞菌 | ||||
| 合计 | ESBLs+ | ESBLs- | 合计 | ESBLs+ | ESBLs- | |||
| 头孢曲松 | S | 28.26 | 16.67 | 50 | 57.14 | 35.29 | 77.78 | 27.27 |
| I | 17.39 | 3.33 | 6.25 | 14.29 | 23.53 | 5.56 | 36.36 | |
| R | 54.35 | 80 | 43.75 | 28.57 | 41.18 | 16.67 | 36.36 | |
| 头孢哌酮/舒巴坦 | S | 78.26 | 66.67 | 100 | 85.71 | 70.59 | 100 | 54.55 |
| I | 4.35 | 6.67 | 0 | 5.71 | 11.76 | 0 | 27.27 | |
| R | 17.39 | 26.67 | 0 | 8.57 | 17.65 | 0 | 18.18 | |
| 哌拉西林/他唑巴坦 | S | 97.83 | 96.67 | 100 | 88.57 | 76.47 | 100 | 27.27 |
| I | 0 | 0 | 0 | 5.71 | 11.76 | 0 | 45.45 | |
| R | 2.17 | 3.33 | 0 | 5.71 | 11.76 | 0 | 27.27 | |
| 左氧氟沙星 | S | 30.43 | 13.33 | 62.5 | 77.14 | 58.82 | 94.44 | 63.64 |
| I | 21.74 | 23.33 | 18.75 | 8.57 | 11.76 | 5.56 | 18.18 | |
| R | 47.83 | 63.33 | 18.75 | 14.29 | 29.41 | 0 | 18.18 | |
| 亚胺培南/西司他丁 | S | 97.83 | 96.67 | 100 | 80 | 58.82 | 100 | 72.73 |
| I | 2.17 | 3.33 | 0 | 8.57 | 17.65 | 0 | 0 | |
| R | 0 | 0 | 0 | 11.43 | 23.53 | 0 | 27.27 | |
| 头孢他啶 | S | 63.04 | 56.67 | 75 | 71.43 | 58.82 | 83.33 | 27.27 |
| I | 4.35 | 3.33 | 6.25 | 11.43 | 17.65 | 5.56 | 27.27 | |
| R | 32.61 | 40 | 18.75 | 17.14 | 23.53 | 11.11 | 45.45 | |
| 头孢吡肟 | S | 50 | 30 | 87.5 | 80 | 23.53 | 94.44 | 36.36 |
| I | 4.35 | 6.67 | 0 | 5.71 | 11.76 | 0 | 9.09 | |
| R | 23.91 | 36.67 | 12.5 | 14.29 | 64.71 | 5.56 | 45.45 | |
| 阿米卡星 | S | 97.83 | 96.67 | 100 | 88.57 | 76.47 | 100 | 27.27 |
| I | 0 | 0 | 0 | 5.71 | 11.76 | 0 | 9.09 | |
| R | 2.17 | 3.33 | 0 | 5.71 | 11.76 | 0 | 63.64 | |
对感染性疾病的病原菌的分布情况以及病原菌的耐药性进行检测有助于提高临床应用抗菌素的针对性和有效性, 并对改善患者的生存预期有积极作用[6]. 腹腔是人体内较大的生理性腔隙, 其内部容纳了众多的实质性器官和空腔性器官[7], 上述器官(尤其是消化道和泌尿生殖系)内部存在着大量的菌群, 一旦发生感染性疾病或外伤, 可以引起上述菌群的播散[8]; 此外, 腹部组织是目前以交通伤为主要类型的各种创伤的主要伤部, 从而造成了较高的外源性感染风险[9].
本研究纳入了92例行腹腔引流的腹腔感染患者, 共检出病原菌145株, 发生复合感染患者的比例较高(57.45%), 构成比前5位的病原菌依次为, 大肠埃希菌, 肺炎克雷伯杆菌, 金黄色葡萄球菌, 肠球菌属, 铜绿假单胞菌. 上述菌群分布与李智博等[10]、赵春江等[11]和王凤霞等[12]就国内医院的研究以及Karlowsky等[13]对亚太地区人群的研究结果较为相似, 而尽管与欧美人群的研究相比肠杆菌科均为腹腔感染的主要致病菌[14,15], 但欧美人群腹腔感染合并真菌感染的比例约为10%以上.
分析革兰氏阳性菌的耐药性, 金黄色葡萄球菌和肠球菌属对常用抗生素都有较高的耐药率, 其中, 肠球菌属对红霉素、氯霉素、左氧氟沙星的耐药率高于金黄色葡萄球菌, 金黄色葡萄球菌对氨苄青霉素的耐药性较高, 但均对万古霉素高度敏感, 未发现万古霉素耐药性菌株. 而大肠埃希菌、肺炎克雷伯杆菌和铜绿假单胞菌等3种G-菌属均存在较高的耐药率, 其中, ESBLs+的菌属以及铜绿假单胞菌对头孢曲松、头孢他啶、头孢吡肟和左氧氟沙星的耐药率较高; 但均对β-内酰胺类/ESBLs抑制剂、亚胺培南/西司他丁和阿米卡星具有较高的敏感性, 这与2013年度CHINET细菌耐药性监测报告较为相似[16]. 肠道定植引起产超广谱ESBL菌类对多数临床常用的头孢菌素类药物不敏感[17], 并在全球范围内都存在较高的流行趋势[18], 而我国ESBLs+的比例超过50%[19-21], 且相对于国外研究, 我国ESBLs对喹诺酮类抗生素的耐药率超过50%[22]; 分析ESBLs+菌属对头孢曲松等常用头孢菌素存在较高耐药性的原因, 除了我国基层医疗机构存在较高的使用率以外, 我国流行的ESBLs主要以blaCTX-M基因突变型较为常见是重要的影响因素[23]. 而我国铜绿假单胞菌、鲍曼不动杆菌等ESBLs基因型的比例也较高, 这也严重限制了上述病原菌的治疗[24,25]. 此外, 本研究还显示, 复方新诺明和阿米卡星等临床使用率较低的"老药"对于肠球菌属、ESBL+的革兰氏阴性菌均有较好的抑制作用, 这一类抗生素的临床研究也是目前多重耐药菌治疗中的热点[26].
通过对纳入研究患者的预后进行分析, 腹腔感染患者的28d死亡率为39.13%(36/92); 应用Cox回归探究影响患者生存的危险因素, 结果显示, 年龄、MDRO、医院感染、ESBLs+和发热至培养时间与腹腔感染患者的死亡相关, 将上述因素纳入多因素Cox回归模型后, 发现MDRO、ESBLs+和发热至培养时间是腹腔感染患者死亡的独立危险因素. 与本研究结果类似, 多项研究也显示, 通过早期进行细菌学培养和药敏[27], 针对性处理MDRO和ESBLs+以及加强感染控制[28], 降低医院ESBLs+的流行程度, 为提高腹腔感染患者的生存率提供较好的基础; 在早期进行细菌学培养和药敏检测的基础上, 还可以降低广谱抗菌素的滥用[29], 对于控制医院感染、有效监测医院感染病原菌分布有积极意义[30].
总之, 腹腔感染患者腹腔引流液中病原菌分布以革兰氏阴性菌为主, 且病原菌对常用抗菌素具有较高的耐药性, MDRO、ESBLs+和发热至培养时间是腹腔感染患者死亡的独立危险因素.
对感染性疾病的病原菌的分布情况以及病原菌的耐药性进行检测有助于提高临床应用抗菌素的针对性和有效性, 并对改善感染患者的生存预期、提高医院感染控制水平有积极作用.
本研究旨在分析近年来天津市宁河区医院腹腔感染患者的致病菌的分布情况, 分析对临床常用抗生素的敏感性, 及其对患者预后的影响, 为指导临床治疗寻求新的思路.
通过对2015年以来就诊腹腔感染患者的病原菌分布和药敏情况进行分析, 了解病原菌的菌属和菌种分布, 比较病原菌对临床常用抗生素的敏感型, 分析影响患者预后的相关危险因素.
在进行描述性回顾分析过程中, 通过应用卡方检验和Fisher确切检验等统计学工具比较了不同菌种对于临床常用抗生素的敏感性, 结合患者的生存预后, 使用单因素和多因素Cox回归模型, 分析了影响患者预后的危险因素.
本研究通过对92例腹腔感染患者的病原菌分布和药敏情况进行分析, 明确了菌属和菌种的分布以及对临床常用抗生素的敏感情况, 并探究了影响患者预后的相关危险因素.
MDRO、ESBLs+和发热至培养时间是腹腔感染患者死亡的独立危险因素. 复方新诺明和阿米卡星等临床使用率较低的"老药"对于多重耐药革兰氏阴性菌均有较好的抑制作用.
本研究的经验教训: 感染样本的正确取样和送检是病原菌的培养和药敏的关键影响因素, 未来研究的方向是提高早期抗感染的针对性并降低病原菌的耐药性, 最佳方法是多中心、大样本、长时间段的横断面调查, 通过动态分析, 监测致病菌的分布与耐药性.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:闫晋利
| 1. | Zhang S, Ren L, Li Y, Wang J, Yu W, Li N, Li J. Bacteriology and drug susceptibility analysis of pus from patients with severe intra-abdominal infection induced by abdominal trauma. Exp Ther Med. 2014;7:1427-1431. [PubMed] [DOI] |
| 2. | Badal RE, Bouchillon SK, Lob SH, Hackel MA, Hawser SP, Hoban DJ. Etiology, extended-spectrum β-lactamase rates and antimicrobial susceptibility of gram-negative bacilli causing intra-abdominal infections in patients in general pediatric and pediatric intensive care units--global data from the Study for Monitoring Antimicrobial Resistance Trends 2008 to 2010. Pediatr Infect Dis J. 2013;32:636-640. [PubMed] [DOI] |
| 3. | Fan S, Wang J, Li Y, Li J. Bacteriology and antimicrobial susceptibility of ESBLs producers from pus in patients with abdominal trauma associated intra-abdominal infections. Eur J Trauma Emerg Surg. 2017;43:65-71. [PubMed] [DOI] |
| 4. | Sartelli M, Chichom-Mefire A, Labricciosa FM, Hardcastle T, Abu-Zidan FM, Adesunkanmi AK, Ansaloni L, Bala M, Balogh ZJ, Beltrán MA. The management of intra-abdominal infections from a global perspective: 2017 WSES guidelines for management of intra-abdominal infections. World J Emerg Surg. 2017;12:29. [PubMed] [DOI] |
| 5. | 王 辉, 宁 永忠, 陈 宏斌, 俞 云松, 王 明贵, 胡 必杰, 陈 佰义, 马 筱玲, 胡 继红, 倪 语星. 常见细菌药物敏感性试验报告规范中国专家共识. 中华检验医学杂志. 2016;38:18-22. [DOI] |
| 6. | Brown ED, Wright GD. Antibacterial drug discovery in the resistance era. Nature. 2016;529:336-343. [PubMed] [DOI] |
| 8. | Petersen MW, Perner A, Ravn F, Sjövall F, Møller MH. Untargeted antifungal therapy in adult patients with complicated intra-abdominal infection: a systematic review. Acta Anaesthesiol Scand. 2018;62:6-18. [PubMed] [DOI] |
| 9. | Zhang H, Yang Q, Liao K, Ni Y, Yu Y, Hu B, Sun Z, Huang W, Wang Y, Wu A. Update of incidence and antimicrobial susceptibility trends of Escherichia coli and Klebsiella pneumoniae isolates from Chinese intra-abdominal infection patients. BMC Infect Dis. 2017;17:776. [PubMed] [DOI] |
| 11. | 赵 春江, 陈 宏斌, 王 辉, 刘 文恩, 卓 超, 褚 云卓, 曾 吉, 金 炎, 胡 志东. 2013年全国13所教学医院院内血流感染及院内获得性肺炎和院内获得性腹腔感染常见病原菌分布和耐药性研究. 中华医学杂志. 2015;95:1739-1746. [DOI] |
| 13. | Karlowsky JA, Hoban DJ, Hackel MA, Lob SH, Sahm DF. Antimicrobial susceptibility of Gram-negative ESKAPE pathogens isolated from hospitalized patients with intra-abdominal and urinary tract infections in Asia-Pacific countries: SMART 2013-2015. J Med Microbiol. 2017;66:61-69. [PubMed] [DOI] |
| 14. | Hawser S, Hoban DJ, Badal RE, Bouchillon SK, Biedenbach D, Hackel M, Morrissey I. Epidemiology and antimicrobial susceptibility of Gram-negative aerobic bacteria causing intra-abdominal infections during 2010-2011. J Chemother. 2015;27:67-73. [PubMed] [DOI] |
| 15. | Lob SH, Biedenbach DJ, Badal RE, Kazmierczak KM, Sahm DF. Discrepancy between genotypic and phenotypic extended-spectrum β-lactamase rates in Escherichia coli from intra-abdominal infections in the USA. J Med Microbiol. 2016;65:905-909. [DOI] |
| 16. | 胡 付品, 朱 德妹, 汪 复, 蒋 晓飞, 孙 自镛, 陈 中举, 胡 志东, 李 金, 谢 轶, 康 梅. 2013年中国chinet细菌耐药性监测. 中国感染与化疗杂志. 2014;14:365-374. [DOI] |
| 17. | Lob SH, Biedenbach DJ, Badal RE, Kazmierczak KM, Sahm DF. Antimicrobial resistance and resistance mechanisms of Enterobacteriaceae in ICU and non-ICU wards in Europe and North America: SMART 2011-2013. J Glob Antimicrob Resist. 2015;3:190-197. [PubMed] [DOI] |
| 18. | Karanika S, Karantanos T, Arvanitis M, Grigoras C, Mylonakis E. Fecal Colonization With Extended-spectrum Beta-lactamase-Producing Enterobacteriaceae and Risk Factors Among Healthy Individuals: A Systematic Review and Metaanalysis. Clin Infect Dis. 2016;63:310-318. [PubMed] [DOI] |
| 19. | Quan J, Zhao D, Liu L, Chen Y, Zhou J, Jiang Y, Du X, Zhou Z, Akova M, Yu Y. High prevalence of ESBL-producing Escherichia coli and Klebsiella pneumoniae in community-onset bloodstream infections in China. J Antimicrob Chemother. 2017;72:273-280. [PubMed] [DOI] |
| 20. | 于 刚, 汪 泳, 汪 正广, 贾 犇黎, 万 圣云, 周 连帮, 钱 波, 程 云生, 刘 志宁. 86例腹腔引流液细菌培养及药敏结果分析. 安徽医学. 2017;38:425-427. [DOI] |
| 23. | 徐 学静, 曹 小利, 张 之烽, 宁 明哲, 周 万青, 张 葵, 沈 瀚. 血培养大肠埃希菌的药物敏感性分析及esbls编码基因的流行性分析. 现代检验医学杂志. 2016;31:55-57. [DOI] |
| 24. | 侯 佳惠, 童 郁, 费 静娴, 郭 美艳, 赵 玉杰, 包 其郁, 周 铁丽. 铜绿假单胞菌超广谱β-内酰胺酶、质粒介导AmpC酶基因分布及流行特征分析. 检验医学. 2012;27:39-43. [DOI] |
| 26. | Lee YR, McMahan D, McCall C, Perry GK. Complicated Intra-Abdominal Infections: The Old Antimicrobials and the New Players. Drugs. 2015;75:2097-2117. [PubMed] [DOI] |
| 27. | 周 华, 李 光辉, 陈 佰义, 卓 超, 曹 彬, 杨 毅, 张 菁, 王 辉, 何 礼贤. 中国产超广谱β-内酰胺酶肠杆菌科细菌感染应对策略专家共识. 中华医学杂志. 2014;94:1847-1856. [DOI] |
| 28. | 黄 勋, 邓 子德, 倪 语星, 邓 敏, 胡 必杰, 李 六亿, 李 家斌, 周 伯平, 王 选锭, 宗 志勇. 多重耐药菌医院感染预防与控制中国专家共识. 中国感染控制杂志. 2015;14:1-9. [DOI] |
| 29. | Årdal C, Røttingen JA, Opalska A, Van Hengel AJ, Larsen J. Pull Incentives for Antibacterial Drug Development: An Analysis by the Transatlantic Task Force on Antimicrobial Resistance. Clin Infect Dis. 2017;65:1378-1382. [PubMed] [DOI] |
| 30. | Sciarretta K, Røttingen JA, Opalska A, Van Hengel AJ, Larsen J. Economic Incentives for Antibacterial Drug Development: Literature Review and Considerations From the Transatlantic Task Force on Antimicrobial Resistance. Clin Infect Dis. 2016;63:1470-1474. [PubMed] [DOI] |